Mikrobioma usus pada tikus menjadi stres dalam waktu 24 jam dengan high-fat diet
Dalam penelitian terbaru yang diterbitkan dalam jurnal Cell Reports, para peneliti di Cincinnati, AS, menilai dampak perubahan pola makan terhadap high-fat diet (HFD) pada usus.
Perubahan pola makan yang signifikan dari waktu ke waktu dapat memengaruhi metabolisme dan fisiologi. Di Amerika Serikat, ketidakseimbangan kalori mungkin menjadi salah satu faktor penyebab obesitas. Dari tahun 1999 hingga 2018, jumlah orang yang menderita obesitas meningkat dari 30,5% menjadi 42,4%, sedangkan penyakit metabolik seperti dislipidemia dan diabetes meningkat dari 25,3% menjadi 34,2%. Variasi pola makan jangka panjang diketahui menyebabkan obesitas dan penyakit metabolik, namun tidak jelas seberapa cepat perubahan pola makan dapat menyebabkan perubahan pada tubuh.
Tentang penelitian
Dalam penelitian ini, para peneliti menilai respons sel epitel usus terhadap HFD menggunakan pengukuran fisiologis dan transkriptomik sel tunggal.
Tim menggunakan kalorimetri tidak langsung untuk mensurvei tikus tipe liar dewasa yang diberi makan makanan normal atau beralih ke HFD selama tujuh hari dan menilai dampaknya. Pertama, jumlah oksigen yang dikonsumsi (VO2) bersama dengan ekspirasi karbon dioksida (VCO2) diperkirakan untuk menghitung respiratory exchange ratio (RER), yang menunjukkan sumber bahan bakar utama yang dimetabolisme tubuh. Juga, tim mengukur energi total yang dibutuhkan untuk homeostasis, yang disebut energy expenditure (EE).
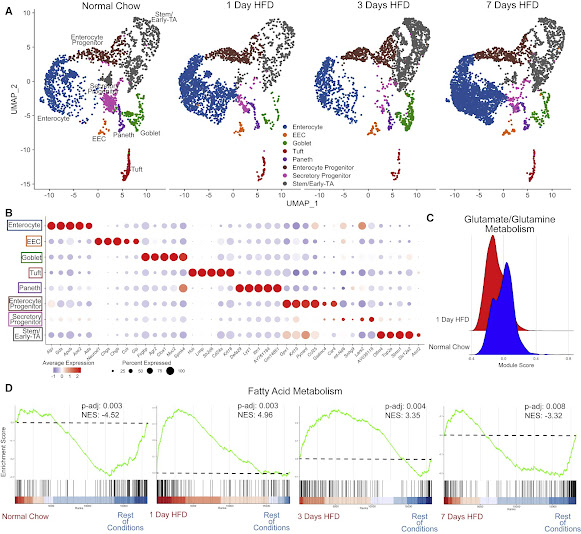
Tim juga menilai apakah respons adaptif di usus proksimal terhadap HFD akut menyebabkan perubahan metabolisme di seluruh tubuh. Proliferasi usus diperiksa bersama dengan kedalaman kripta dan tinggi vili setelah satu, tiga, atau tujuh hari pada HFD. Single-cell ribonucleic acid sequencing (scRNA-seq) juga dilakukan pada duodenum tikus dewasa dan sel epitel jejunum di semua titik waktu. Setelah memeriksa kualitas sel dan memfilternya, tim menggabungkan kumpulan data sel yang diperoleh dari tikus yang mengonsumsi makanan normal dan tikus yang diberi makan HFD selama satu, tiga, atau tujuh hari. Sel chow normal digunakan sebagai dataset referensi.
Tim selanjutnya menganalisis bagaimana setiap kelompok sel merespons HFD menggunakan analisis ekspresi gen diferensial. Tanda tangan transkripsi yang terkait dengan metabolisme glutamat/glutamin juga dievaluasi menggunakan gen dari Molecular Signatures Database (MSigDB).
Hasil
Dalam hari pertama pemberian HFD, tingkat RER menurun dari sekitar 0,9 menjadi 0,8, dan perbedaan ini dipertahankan dari waktu ke waktu. Pada hari pertama, EE naik dari sekitar 0,2 hingga 0,5 kkal/menit menjadi hampir 0,4 hingga 0,6 kkal/menit. Selama tujuh hari, tidak ada perbedaan yang signifikan dalam jumlah air yang dikonsumsi atau pergerakan rawat jalan. Tikus yang diberi makan HFD bertambah berat sambil menunjukkan asupan energi yang lebih tinggi dari hari pertama. Setelah satu hari mengkonsumsi HFD, hasil ini menunjukkan bahwa metabolisme mencit berubah di seluruh tubuh, dan mungkin juga terjadi perubahan pada usus mereka.
One day of HFD induces changes in mouse metabolism and intestinal proliferation (A) Diagram of feeding schedule in metabolic cages. Mice underwent 2 days of acclimation to the cages, and all consumed normal chow (brown-color pellets) during the acclimation period. The dashed line denotes when mice were divided into two groups, one maintained on normal chow (n = 5), and the other group switched to high-fat diet (HFD; n = 6) for 7 days. (B) Average oxygen consumption. (C) Average carbon dioxide expiration rate. (D) Average respiratory exchange rate ratio calculated by VCO2/VO2. (E) Average energy expenditure measured in kcal/min captured from animals fed normal chow (gray line) and HFD (blue line). Yellow shading indicates light cycle, whereas gray shading indicates night cycle. The dashed line indicates the end of the acclimation period and beginning of dietary challenge. (F) Percentage of daily weight change measured in grams (g), n = 11 normal chow, n = 20 HFD. (G) Average daily energy intake measured in kcal/g, n = 11 normal chow, n = 20 HFD. (H) Average accumulated food intake over time with calculated average slopes displayed, n = 11 normal chow, n = 20 HFD. (I) Immunofluorescence images of the proximal jejunum of mice fed normal chow (blue border) and 1 day of HFD (red border) after a 2 h pulse with EdU to label actively proliferating cells (green). Nuclei are stained in white, and Cdh1 marks the epithelium in purple. Scale bars: 100 μm. (J) Quantification of (I), n = 6 normal chow, n = 5 HFD. (B–E and J) One-way ANOVA. Error bars are SD. (F–H) Two-way ANOVA; ∗p < 0.05, ∗∗p < 0.0005, ∗∗∗p < 0.0003, ∗∗∗∗p < 0.0001.
HFD initiates a rapid increase in expression of genes regulating fatty acid metabolism (A) Integrated analysis of jejunal epithelial sorted dataset: normal chow (reference dataset for integration, 2,214 cells), 1 day of HFD (2,309 cells), 3 days of HFD (2,353 cells), and 7 days of HFD (3,717 cells). (B) Average dot plot expression of top 5 genes per cluster. (C) Ridge plot between normal chow and 1 day of HFD depicting module gene score calculated for glutamate/glutamine metabolism. (D) Gene set enrichment analysis (GSEA) using all clusters focusing on Hallmark fatty acid metabolism genes compared between each dietary condition. Green line denotes enrichment score for each cell per condition. Dashed line marks score at 0.0. Black lines above color gradient denote localization of Hallmark fatty acid metabolism genes. Blue (low) to red (high) color gradient depicts enrichment score expression. Adjusted p value (p-adj) and normalized enrichment score (NES) are reported in panel.
Ada peningkatan penggabungan EdU (5-ethynyl-2'-deoxyuridine) setelah satu hari konsumsi HFD. Namun, kedalaman kripta usus atau ketinggian vili tidak berubah. Tim juga menilai setiap perubahan dalam kematian sel usus menggunakan pewarnaan caspase-3 yang dibelah bersama dengan pewarnaan terminal deoxynucleotidyl transferase deoxyuridine triphosphate nick end labeling (TUNEL) dan tidak menemukan perbedaan pada titik waktu yang dinilai. Hasil ini menunjukkan bahwa HFD menyebabkan respons proliferatif dalam satu hari, tetapi ini tidak mengubah ukuran area permukaan usus selama satu minggu. Selain itu, semua jenis sel yang diharapkan, seperti EEC, enterocytes, enterocyte progenitors (EPs), goblet, Paneth cells, secretory progenitors (SPs), tuft, dan stem/early-transit amplifying (TA) zone cells, diidentifikasi.
HFD triggers an immediate stress response (A) Cell stress module gene scores between dietary conditions in enterocyte, enteroendocrine (EEC), goblet, tuft, Paneth, enterocyte progenitor, secretory progenitor, and stem/early-TA clusters. (B) qRT-PCR between dietary conditions for heat-shock protein 1A (Hspa1a), Hspa1b, and heat-shock protein 90, alpha (cytosolic), class A member 1 (Hsp90aa1). n = 5–9 mice. (C) Transmission electron microscopy (TEM) images of crypts from animals fed normal chow and 1 day of HFD. Dashed line outlines the bottom of the crypt, while the red-pseudocolor denotes a representative Paneth cell. Scale bars: 4 μm. (D) Dot plot depicting average gene expression of heat-shock-related genes in stem/early-TA zone cells. (E) GSEA of Hallmark unfolded protein response genes comparing stem/early-TA zone cells between normal chow and 1 day of HFD. (F) Dot plot depicting average gene expression of genes involved in defensin regulation in Paneth cells. (G) GSEA of Hallmark inflammatory response genes comparing Paneth cells between normal chow and 1 day of HFD. Green line denotes enrichment score for each cell per condition. Dashed line marks score at 0.0. Black lines above color gradient denotes localization of Hallmark genes. Blue (low) to red (high) color gradient depicts enrichment score expression.
Analisis perubahan transkripsional yang diinduksi oleh HFD dilakukan dengan Biological Process Gene Ontology Terms (GO-Terms), yang menunjukkan bahwa gen untuk jalur metabolisme asam lemak memiliki tingkat ekspresi yang lebih tinggi dalam beberapa tipe sel hanya setelah satu hari HFD. Ini menunjukkan bahwa epitel usus bergeser dari metabolisme glutamin / glutamat yang biasanya digunakan. Ada juga downregulation langsung diamati setelah satu hari HFD. Gene set enrichment analysis (GSEA) menunjukkan bahwa sebagian besar sel epitel telah meningkatkan regulasi gen yang memfasilitasi metabolisme asam lemak, sebagaimana dibuktikan dengan normalized enrichment scores (NESs). Secara khusus, NES yang terkait dengan metabolisme asam lemak meningkat pada satu dan tiga hari HFD. Ini menunjukkan bahwa metabolisme tubuh bereaksi cepat terhadap peningkatan lemak luminal. Pada tujuh hari, SEN metabolisme asam lemak telah menurun untuk menunjukkan bahwa enterosit telah beradaptasi dengan perubahan menjadi HFD.
Transcriptional responses of enterocytes correlate with improved lipid absorption and transport (A) Lipid absorption score compared between enterocytes in each dietary condition. (B) qRT-PCR between dietary conditions for fatty acid binding protein 1 (Fabp1), apolipoprotein A-IV (Apoa4), and carnitine palmitoyltransferase 1a (Cpt1a). (C) Uniform manifold approximation and projection (UMAP) of enterocytes reclustered into 5 subsets: 0 (1,735 cells), 1 (1,671 cells), 2 (847 cells), 3 (281 cells), and 4 (200 cells). Barplot visualizes cluster proportion colored by cluster number. Breakdown per condition: normal chow (675 cells), 1 day of HFD (1,308 cells), 3 days of HFD (549 cells), and 7 days of HFD (2,202 cells). (D) Top 3 upregulated Gene Ontology terms (Biological Process) for normal chow and 7 days of HFD in enterocyte subclusters −0 and −1. (E) Diagram of BODIPY pulse-chase experiment. Normal chow, gray arrow; HFD, blue arrow; green dashed line denotes time when all mice were gavaged with BODIPY and analyzed 2 h later. (F) Fluorescence images of BODIPY (green) lipid absorbance in proximal jejunum 2 h post-gavage. DAPI counterstains nuclei in blue. Scale bars: 100 μm. (G) Quantification of BODIPY fluorescence intensity. n = 4 per condition. (H) Oil red O staining of proximal jejunum for each condition. Scale bars: 100 μm. (I) Quantification of (H) reported as optical density (OD) for oil red O accumulation. n = 7 for each condition. (A, F, and H) Error bars are SEM. One-way ANOVA; ns, not significant, ∗p < 0.05, ∗∗p < 0.005, ∗∗∗∗p < 0.0001.
Setelah satu hari di HFD, terjadi peningkatan regulasi gen terkait stres untuk semua populasi sel epitel. Berdasarkan data scRNA-seq, stem/early-TA, bersama dengan sel Paneth, cenderung menunjukkan perubahan dramatis dalam ekspresi gen sebagai respons terhadap tekanan seluler. Subset batang / TA awal ditemukan untuk meningkatkan regulasi gen protein kejut panas, dan GSEA meningkatkan regulasi gen unfolded protein response (UPR). Hal ini menunjukkan bahwa sel punca/TA awal segera bereaksi terhadap HFD dengan respons stres.
Studi ini menunjukkan pendekatan multi-cabang untuk menilai bagaimana hewan merespons perubahan pola makan dengan mengevaluasi metabolisme seluruh tubuh, fungsi jaringan, morfologi, dan transkriptomik sel tunggal. Analisis fungsional dan transkripsi menunjukkan bahwa semua jenis sel epitel usus diubah dalam waktu 24 jam. Selanjutnya, dalam seminggu, epitel usus telah dimodifikasi untuk memaksimalkan penyerapan lemak. Plastisitas dinding usus mungkin telah berevolusi selama masa kelangkaan nutrisi tetapi sekarang dapat dikaitkan dengan obesitas, penyakit metabolik, dan peradangan selama masa kelebihan nutrisi.
HFD causes a transcriptional shift in cell lineage trajectory from secretory to absorptive (A) Distribution of epithelial cells depicted as density plot split between mice eating normal chow (top panel) and 3 days of HFD (bottom panel). Yellow (low) to red (high) color gradient depicts density value. (B) STREAM pseudotime analysis for epithelial cells from mice eating normal chow and 3 days of HFD. Stem cluster was used as the origination node and then unbiased analysis of clustering with 5 branches. (C) PAGA pseudotime analysis for epithelial cells from mice eating normal chow and 3 days of HFD. Dark purple to yellow color gradient depicts computed trajectory from early- to late-stage differentiation. (D) Integrated reference analysis for secretory enriched (sorted TdTom+) cells for each condition colored by each cluster. Red box at 3 days of HFD focuses on emerging cluster of new cells bridging between secretory progenitor and enterocyte clusters. (E) Distribution of secretory-enriched cells depicted as density plot split between mice eating normal chow and 3 days of HFD. (F) STREAM pseudotime analysis for secretory enriched cells from mice eating normal chow and 3 days of HFD. Stem cluster was used as the origination node and then unbiased analysis of clustering with 3 branches. (G) PAGA pseudotime analysis for secretory-enriched cells from mice eating normal chow and 3 days of HFD. Dark purple to yellow color gradient depicts computed trajectory from early- to late-stage differentiation. (H) Diagram delineating intestinal epithelial cell transcriptional differentiation priority during normal chow and the adaptive response to HFD. ST, stem/early-TA zone; EP, enterocyte progenitor; SP, secretory progenitor; Ent, enterocyte; EEC, enteroendocrine cell; P, Paneth; G, goblet. Circle size denotes relative transcriptional cell abundance. Red arrows during HFD indicate potential shift of cells toward enterocyte progenitors and enterocytes.
Journal reference:
Jacob R. Enriquez, Heather A. McCauley, Kevin X. Zhang, J. Guillermo Sanchez, Gregory T. Kalin, Richard A. Lang, James M. Wells, A dietary change to a high-fat diet initiates a rapid adaptation of the intestine, Cell Reports, Volume 41, Issue 7, 2022, 111641, ISSN 2211-1247, DOI: https://doi.org/10.1016/j.celrep.2022.111641, https://www.sciencedirect.com/science/article/pii/S2211124722015121











No comments