Penelitian menyoroti mekanisme patologi jantung COVID-19
Dalam studi terbaru yang diterbitkan dalam jurnal Angiogenesis, tim peneliti membandingkan sampel otopsi jantung dari kasus positif severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) dengan sampel yang sesuai usia dari kasus influenza hemagglutinin 1 neuraminidase 1 (H1N1), kasus miokarditis limfositik non-influenza, dan jaringan jantung tanpa peradangan untuk memahami mekanisme yang mendasari patologi komplikasi jantung selama penyakit coronavirus 2019 (COVID-19).
Latar belakang
Meskipun COVID-19 sebagian besar merupakan penyakit pernapasan, hasil klinis dari infeksi SARS-CoV-2 yang parah terlihat memengaruhi banyak sistem organ. Disfungsi endotel, trombosis mikro, dan hiperkoagulasi terkait dengan presentasi mirip miokarditis dari gangguan fungsi jantung telah diamati pada 20% hingga 30% kasus COVID-19 yang dirawat di rumah sakit. Selain itu, remodeling vaskular dan pembentukan mikrotrombi berhubungan dengan peningkatan penanda serum jantung, penyakit parah, dan kematian.
Meskipun jumlah kasus COVID-19 meningkat dengan hasil klinis yang melibatkan komplikasi jantung, mekanisme patologi jantung dan cedera jantung selama infeksi SARS-CoV-2 yang parah masih belum jelas. Hipotesis saat ini termasuk kerusakan dinding miokard dan pembuluh darah akibat badai sitokin, yang merupakan peningkatan pelepasan sitokin proinflamasi seperti interleukin (IL) 1 dan 6, tumor necrosis factor-alpha (TNF-α), dan interferon-gamma (IFN-γ), dan keberadaan partikel virus SARS-CoV-2 dalam kardiomiosit dan makrofag jantung.
Karena gejala jantung yang diamati pada COVID-19 mirip dengan bentuk miokarditis virus lainnya, membandingkan jaringan otopsi jantung dari penyakit ini dapat menjelaskan mekanisme patologi jantung COVID-19.
Tentang penelitian
Dalam penelitian ini, tim menganalisis 24 sampel jaringan otopsi jantung dari kasus kematian SARS-CoV-2 dan membandingkannya dengan jenis kelamin, usia, dan jaringan jantung yang diarsipkan dengan tingkat keparahan penyakit yang paling mendekati dari 16 influenza H1N1 dan eight non-H1N1 serta non- SARS-CoV-2 related myocarditis mortalities. Sampel jaringan jantung dari sembilan operasi jantung yang tidak menular dan tidak terkait penyakit inflamasi digunakan sebagai kontrol.
Sejumlah besar kasus di masing-masing kelompok telah menunjukkan penanda serum yang menunjukkan keterlibatan jantung, seperti troponin, creatine kinase myocardial band (CK-MB), N-terminal prohormone of brain natriuretic peptide (NT-proBNP), left or right ventricular ejection fraction (LVEF/RVEF), dan kelainan pada ekokardiograf.
Berbagai teknik digunakan untuk menganalisis perubahan molekuler dan morfologis dalam sampel jaringan jantung, termasuk histopatologi, imunohistokimia multipleks, mikroskop tomografi radiasi sinkrotron, pengecoran korosi mikrovaskular, dan analisis ekspresi gen. Spike SARS-CoV-2 dan protein nukleokapsid digunakan untuk analisis imunohistokimia. Selain itu, ribonucleic acid (RNA) fluorescence in situ hybridization (FISH) dan reverse transcription polymerase chain reaction (RT-PCR) digunakan untuk mendeteksi RNA SARS-CoV-2 dari sampel yang tertanam parafin dengan formalin.
Hasil
Hasilnya menunjukkan bahwa tidak ada sampel jaringan jantung COVID-19 yang dapat didiagnosis sebagai miokarditis virus berdasarkan histopatologi. Namun, dibandingkan dengan jaringan jantung dari pasien influenza dan miokarditis non-SARS-CoV-2, jaringan otopsi jantung COVID-19 menunjukkan peningkatan gugus molekul diferensiasi perivaskular 11b (CD11b)/reseptor angiopoietin-1 (TIE2) yang menunjukkan makrofag selama imunohistokimia multipleks.
A–D MPX staining of cardiac tissue depicting CD68 + macrophages in orange, CD4 + T helper cells in green, CD8 + cytotoxic T cells in yellow, and CD20 + B-cells in magenta. All infected hearts (COVID-19, influenza, and lymphocytic non-influenza myocarditis) displayed a prominent infiltrate of CD68 + macrophages. While COVID-19 A (COVID-19 patient ID 24) and influenza, B (Influenza patient ID 9) hearts showed nearly absent lymphocytic infiltrate, lymphocytic non-influenza myocarditis, C (Myocarditis patient ID 5) was characterized by a mixed, T-cell dominated infiltrate. Non-infected control hearts, D (Control patient ID 1) showed markedly less inflammatory cells with a mixed population of macrophages and predominant t-cells and only scarce B-cells. Magnification 400x. Scale bars = 100 µm. E Histogram of the inflammatory cell infiltrates (CD20, CD4, CD68, CD8). Cell counts are normalized to cells per mm2 myocardial tissue. *p < 0.05, **p < 0.01, ***p < 0.001
Selain itu, jaringan jantung dari pasien COVID-19 juga menunjukkan ekspresi gen transisi epitel-mesenkim dan faktor angiogenesis, yang tidak diamati pada jaringan jantung dari kelompok lain. Ini mendukung hipotesis bahwa badai sitokin selama COVID-19 dikaitkan dengan kerusakan endotel dan edema miokard. Selain itu, peningkatan angiogenesis intususepsi dan trombus multifokal pada jaringan jantung COVID-19 diidentifikasi sebagai bukti remodeling vaskular. Penyakit kardiovaskular lainnya seperti aterosklerosis, miokarditis virus akibat parvovirus B19, penyakit radang, dan kanker juga menunjukkan angiogenesis intususepsi.
Faktor turunan sel stroma 1/ C-X-C chemokine receptor type 4 axis (SDF-1/CXCR4) dianggap memainkan peran penting dalam perbaikan miokard selama infark miokard, miokarditis virus, dan kardiomiopati melalui perekrutan mononuklear yang diturunkan dari sumsum tulang sel. Peningkatan makrofag CD11b/TIE2+, upregulasi SDF-1, CXCR4, dan matrix metallopeptidase 9 (MMP9), dan peningkatan bersamaan dalam angiogenesis intususepsi yang terlihat dalam penelitian ini mendukung peran sumbu SDF-1/CXCR4 dalam perbaikan miokard.
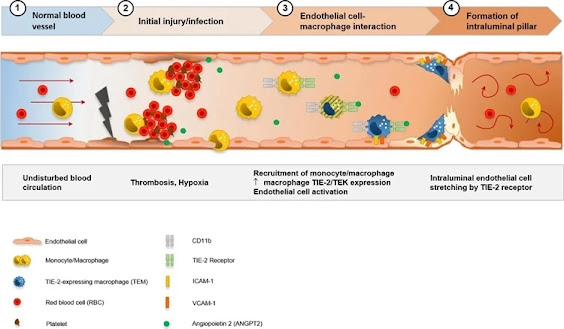
Visualization of the hypothesis of CD11b + /TIE2 + monocytes/macrophages recruitment and incorporation, and intussusceptive angiogenesis in the cardiac vasculature in COVID-19. SARS-CoV-2-related endothelial dysfunction results in thrombotic microangiopathy in cardiac capillaries and tissue hypoxia. Endothelial cells induce the recruitment of monocytes/macrophages to the site of injury by upregulation of adhesion-molecules and activation of SDF-1/CXCR4 signaling. TIE2 + monocytes/macrophages are activated by increased levels of angiopoietin 1 and adhere locally in response to angiopoietin 2 to endothelial cells. Formation of an intussusceptive pillar is achieved by intraluminal stretching of endothelial cells under the help of adherent TIE2 + monocytes/macrophages resulting in the division of a single capillary altering the cardiac microvasculature
Kesimpulan
Singkatnya, penelitian ini menyelidiki mekanisme yang mendasari kerusakan jaringan jantung yang terkait dengan kasus COVID-19 yang parah dengan membandingkan jaringan otopsi jantung dari pasien COVID-19 dengan yang dari influenza H1N1, miokarditis non-virus, dan kardiak non-infeksi dan non-inflamasi. jaringan pembedahan.
Secara keseluruhan, hasil menunjukkan bahwa jaringan jantung COVID-19 tidak mirip dengan jaringan jantung miokarditis virus konvensional dalam hal infiltrasi dan kerusakan yang diamati. Selain itu, angiogenesis intususepsi yang menyebabkan remodeling vaskular ireversibel adalah salah satu penyebab utama cedera jantung selama COVID-19 yang parah.
Journal reference:
Werlein, C., Ackermann, M., Stark, H., Shah, H. R., Tzankov, A., Haslbauer, J. D., von Stillfried, S., Bülow, R. D., El-Armouche, A., Kuenzel, S., Robertus, J. L., Reichardt, M., Haverich, A., Höfer, A., Neubert, L., Plucinski, E., Braubach, P., Verleden, S., Salditt, T., & Marx, N. (2022). Inflammation and vascular remodeling in COVID-19 hearts. Angiogenesis. https://doi.org/10.1007/s10456-022-09860-7, https://link.springer.com/article/10.1007/s10456-022-09860-7








No comments